17. ДВИЖЕНИЕ ЭЛЕКТРОНОВ В ПОЛЕ ДВУХ ЯДЕР И ХИМИЧЕСКАЯ СВЯЗЬ
Рассмотрение этого вопроса является ключевым моментом в теории химической связи. Обращаю внимание читателя на то, что материал, изложенный в этой главе, полностью является достоянием новой физики (химии). Официальная наука в теории химической связи продолжает возиться с электронными “облаками”, однако, называя их уже “орбиталями”. Взаимодействие атомов объясняется “перекрытием” волновых функций. В связи с этим, сравнивать альтернативную химию не с чем, кроме ионной связи, в которой современная химия использует классические представления, поэтому не имеет различий с новой физикой.
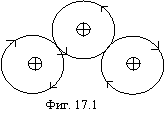 |
Очевидно, что движение электронов в устойчивых атомах и молекулах должно происходить синхронизировано и таким образом, чтобы картина расположения электронов в данный момент времени периодически повторялась. В противном случае электроны будут мешать друг другу в определенные моменты времени, когда они, по необходимости, должны находиться в непосредственной близости друг от друга, что по энергетическим соображениям невозможно. Очевидно также и то, что, поскольку электрон является вращающимся волчком (об этом ниже), его движение возможно только в одной плоскости. Если в этой плоскости находится несколько ядер, то траектория движения электрона будет такой, как изображена на фигуре 17.1, что является следствием инерционности электрона (при прочих равных условиях он предпочитает двигаться прямолинейно).
Кроме того, электроны стремятся накопиться в торе в возможно большем количестве (см. фиг. 15.7) до 8 штук за исключением третьего и шестого электрона, чтобы обеспечить минимум потенциальной энергии за счет магнитного взаимодействия орбит. За исключением водорода и гелия, все остальные атомы в качестве наружных электронов имеют электроны, образующие тор. Электроны водорода и гелия можно рассматривать в любом качестве.
Поскольку магнитное взаимодействие электронных орбит играет важную
роль, как при образовании атома, так и при образовании молекул, следует
уточнить, в какой части эллипсовидной орбиты магнитное взаимодействие наиболее
сильно. Очевидно, что это наблюдается вблизи ядра из-за большой скорости
движения электрона и малого радиуса этого движения. Поэтому, без большого
ущерба для магнитного взаимодействия, орбита электрона может быть повернута на
угол ![]() 900
в плоскости орбиты с тем, чтобы обеспечить максимально возможное расстояние
между ядрами атомов, тем самым, обеспечив минимум потенциальной энергии.
Поэтому молекулы из трех атомов стремятся образовать линейную структуру, из
четырех - тетраэдр и т.д., образуя ряд правильных пространственных фигур,
искажения которых зависят от степени гетероядерности составляющих атомов, а
точнее, от степени асимметрии электростатического поля. Для удобства, мы будем
изображать плоские молекулы в большинстве случаев.
900
в плоскости орбиты с тем, чтобы обеспечить максимально возможное расстояние
между ядрами атомов, тем самым, обеспечив минимум потенциальной энергии.
Поэтому молекулы из трех атомов стремятся образовать линейную структуру, из
четырех - тетраэдр и т.д., образуя ряд правильных пространственных фигур,
искажения которых зависят от степени гетероядерности составляющих атомов, а
точнее, от степени асимметрии электростатического поля. Для удобства, мы будем
изображать плоские молекулы в большинстве случаев.
Изложенные принципы движения электрона позволяют конкретизировать различные типы химической связи.
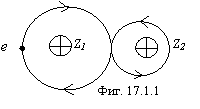 |
Эта связь характерна для гетероядерных атомов с большой асимметрией общего электростатического поля, при которой невозможно удовлетворить условие синхронного движения двух электронов, участвующих в связи, поэтому связь осуществляется одним электроном, как показано на фиг. 17.1.1 (Z2>Z1).
Как видно из рисунка, большую часть времени электрон проводит между ядрами, поэтому образовавшаяся молекула устойчива.
Примером химических соединений со связью, соответствующей фиг. 17.1.1 являются соединения кислорода и водорода на фигуре 17.1.2.
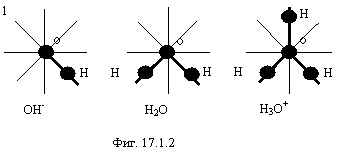 |
Орбиты электронов в виде черточек мы видим сверху, и они образуют 8-электронный тор вокруг ядра кислорода. Другие электроны не показаны. Электронные орбиты, образованные электроном водорода выделены жирной чертой (в дальнейшем этого делать не будем из-за неразличимости электронов). Чтобы осуществить синхронизацию с электроном связи, у электрона, обозначенного цифрой 1 (OH-) есть две возможности, выбор из которых определяется энергетическими соображениями. Или он вынужден азимутально повернуть орбиту в плоскость, не совпадающую с плоскостью орбиты электрона, осуществляющего связь, или, в пределах, разрешаемых общим выигрышем энергии деформировать орбиту таким образом, чтобы синхронизация стала возможна. Второй путь представляется более вероятным, т.к. необходимая деформация орбиты невелика. Поскольку образование 8-электронного тора очень выгодно, соединение OH вынуждено приобрести недостающий электрон из среды, образуя гидроксил, а H3O вынужден отдать электрон в среду, образуя гидроксоний. Таким образом, вода представляет собой смесь частиц, изображенных на фигуре 17.1.2. Адекватность фигуры 17.1.2 реальным фактам подтверждается тем, что в твердых гидратах кислот находят ион гидроксония и соответствующий анион кислоты, а не другие частицы. Ф. Коттон, Дж. Уилкинсон “Современная неорганическая химия”, “Мир”, М., 1969, 2 часть, стр.14, табл. 6.1.
Принцип образования молекул СН4 и Ccl4 точно такой, как изложено выше, а официальная химия вынуждена для этого случая придумывать свои объяснения. “В основном состоянии атом углерода имеет конфигурацию 1s22s22px2py и, следовательно, имеет только два неспаренных электрона. Поэтому, кажется, следовало бы ожидать, что с атомами X, имеющими один неспаренный электрон (H, F, Cl и т.д.), наиболее устойчивые производные его должны были бы быть типа CX2. Конечно, это противоречит фактам - его более устойчивые соединения с такими атомами обладают структурой типа CX4, например, CH4 и CCl4. Чтобы объяснить это, следует предположить, что электронная конфигурация атома углерода меняется так, что появляются четыре неспаренных электрона перед тем, как он соединяется с четырьмя атомами X”. Там же, 1 часть, стр. 86.
Как видим, для одноэлектронной связи понятие валентности не подходит. Как будет видно из дальнейшего, то же можно сказать и о других типах связи.
17.2. Связь с передачей электрона
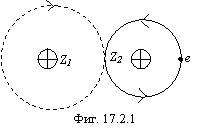 |
Это предельный случай одноэлектронной связи, когда электрон полностью передается в оболочку другого атома, что изображено на фиг. 17.2.1.
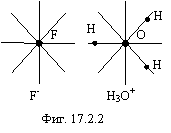 |
Примером может служить твердый гидрат HF×H2O, изображенный на фигуре 17.2.2. Подобные соединения образуют ионную кристаллическую решетку.
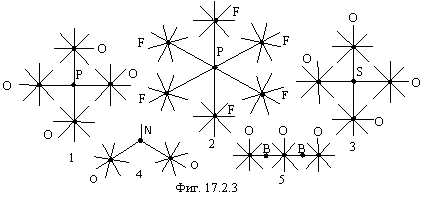 |
На фигуре 17.2.3 приведены некоторые примеры комбинированной связи
одноэлектронной и с передачей электрона. 1 -![]() . Атом фосфора передает один электрон одному
из атомов кислорода, еще три электрона из среды. 2 -
. Атом фосфора передает один электрон одному
из атомов кислорода, еще три электрона из среды. 2 -![]() . Атом фосфора принимает один
электрон из среды. 3 -
. Атом фосфора принимает один
электрон из среды. 3 -![]() .
Атом серы передает два электрона двум атомам кислорода. Еще два электрона из
среды. 4 –NO2. Атом азота передает
два электрона двум атомам кислорода. 5 –B2O3. Два атома бора передают по электрону двум
атомам кислорода.
.
Атом серы передает два электрона двум атомам кислорода. Еще два электрона из
среды. 4 –NO2. Атом азота передает
два электрона двум атомам кислорода. 5 –B2O3. Два атома бора передают по электрону двум
атомам кислорода.
 |
Несмотря на то, что одноэлектронная связь, связь с передачей электрона и двухэлектронная связь имеют существенные отличия от теории Льюиса (“Основная идея теории Льюиса заключается в том, что химическая связь обусловлена тем, что два атома совместно владеют одной (или более) парой электронов”. Ф. Коттон, Дж. Уилкинсон, Современная неорганическая химия, Мир, М., 1969, 1 часть, стр.75), тем не менее, они одинаковы в главном: при образовании молекулы электроны перераспределяются таким образом, чтобы образовать 8-электронную оболочку.
 |
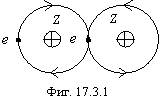
Эта связь характерна для гомоядерных атомов, для атомов с одинаковой структурой внешней оболочки, т.е. для случаев симметричного общего электростатического поля. Этот тип связи изображен на фигуре 17.3.1.
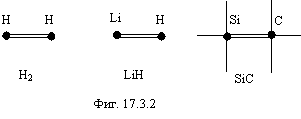
Три и более электронов уже не в состоянии синхронно двигаться по траектории, поэтому более двух электронов не могут участвовать в связи атомов. Сама связь реализуется за счет комбинированного электростатического и магнитного взаимодействия. На фигуре 17.3.2 приведены примеры такой связи. Она обозначена двойной чертой.
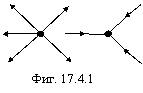 |
Этот тип связи не сопровождается обобществлением или передачей электронов и обусловлен встраиванием одной тороидальной электронной оболочки в другую, как показано на фигуре 17.4.1 (направление движения электронов показано стрелками).
Такой тип связи, по мнению автора, обуславливает возникновение нестехиометрических соединений.
Эта связь относится к случаю гомоядерных атомов с чисто магнитным взаимодействием тороидальных электронных оболочек (аналогично гравидинамическому взаимодействию нуклонов в ядрах, см. теорию ядра), что отражено на фигуре 17.5.1. Очевидно, что наиболее характерным химическим соединением с таким типом связи будет молекула A2, т.к. магнитный поток за пределы такой молекулы практически не выходит. Конечно, возможно и образование крайне неустойчивых молекул А3, например, озон. Это зависит от числа электронных орбит атома.
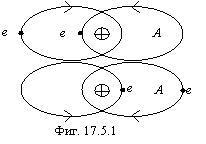 |
Прочность A2 будет зависеть от количества "витков" (электронных орбит) в тороидальной "обмотке" А. Если атомы А имеют по одному электрону, то связь реализуется по варианту двухэлектронной связи (фиг. 17.3.1). Если атомы А имеют по два электрона, то связь по варианту фиг. 17.3.1 реализоваться уже не может, а по варианту фиг. 17.5.1 еще очень слаба. При увеличении числа электронных орбит в "обмотке" тора, прочность тороидальной связи будет сначала практически линейно увеличиваться, затем резко падать, поскольку магнитное поле сосредотачивается внутри "обмотки" и наружу почти не проникает. Поэтому у инертных газов образование молекул A2 невозможно ни по механизму фиг. 17.3.1, ни по механизму фиг. 17.5.1. В качестве иллюстрации, ниже приведены энергии связи (в ккал/моль) элементов, образующих первую тороидальную электронную оболочку: Li2=25, Be2=0?, B2=69, C2=150, N2=225, O2=118, F2=36, Ne2=0. Особенностью химических соединений с тороидальной связью является отсутствие дипольного момента молекул. Одновременно здесь следует указать, что описанная тороидальная связь устраняет противоречие, возникающее при квантовомеханическом рассмотрении молекулы О2. “Существует один случай, в котором простой метод ВС (валентных связей - В.К.) ведет к качественно некорректному предсказанию электронного строения, - молекула О2. Атом кислорода в основном состоянии имеет конфигурацию 1S22S22px22py2pz, и поэтому можно ожидать, что два атома соединятся, образуя две двухэлектронные связи. Действительно, для молекулы О2 энергия связи указывает на двойную связь, но эта молекула имеет также два не спаренных электрона, т.е. такое сочетание факторов, которое трудно осмыслить и еще труднее предсказать, опираясь на метод валентных связей”. Ф. Коттон, Дж. Уилкинсон “Современная неорганическая химия”, “Мир”, М., 1969, 1 часть, стр.81.
На фигуре 17.5.2 приведены примеры некоторых интересных химических соединений с точки зрения проанализированных типов связей.
 |
Mo(CO)6. Октаэдр (Фиг. 17.5.2а). Присоединение иона CO- происходит за счет четырех электронов внутренней квазикруговой орбиты и двух электронов четвертого тора Мо. При этом остается электронная структура Kr и дальнейшее извлечение электронов на связь невозможно.
C6H6. Бензол (Фиг. 17.5.2б). Все связи С-С равноценны.
Al[BH4]3. Гидридный комплекс (Фиг. 17.5.2в). BH4- - тетраэдр.
B2H6 (Фиг. 17.5.2г). Две молекулы BH3 в том положении, в котором изображены, накладываются друг на друга и удерживаются за счет тороидальной связи.
Соединения с инертными газами (магнитная связь, Фиг. 17.5.2д): XeF2, XeO4 (тетраэдр) и XeO3 (тригональная пирамида).
Как видно из схем строения молекул, большинство их не имеют магнитного момента из-за полной симметрии движения электронов. Поэтому магнитный момент молекул определяется в основном магнитными моментами ядер. Современная физика указанный факт объясняет нулевым орбитальным и спиновым моментом.