16. О ПОТЕНЦИАЛАХ ИОНИЗАЦИИ АТОМОВ
В таблицах экспериментальных значений потенциалов ионизации зашифровано много информации о строении атомов, но, пока, эта информация не используется достаточно эффективно из-за отсутствия конструктивных идей. Знания, которые мы почерпнули из предыдущих глав могли бы внести ясность в этот вопрос (качественно, эти таблицы стали уже ясны и в них нет ни одной "аномальной" цифры), но дело сильно осложняется тем, что энергия связи данного электрона с ядром включает не только электростатическое взаимодействие, но и взаимодействие данного электрона со всеми другими электронами и одновременно действующее магнитное взаимодействие. Кроме того, при удалении электрона происходит перестройка всей электронной структуры атома. При одной и той же структуре электронов, с увеличением заряда ядра эксцентриситет орбит электронов, как мы выяснили на примере гелия, падает сначала резко, затем медленно. Это приводит к упрочнению связи электрона с ядром за счет более близкой к круговой орбиты с одной стороны, и к ослаблению этой связи за счет большего взаимодействия с другими электронами, с другой стороны. У нас имеется аналитическое выражение только для одного из трех одновременно меняющихся параметров - энергии связи данного электрона с ядром, которую из теории водородоподобных атомов можно записать так:
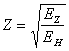 (16.1),
(16.1),
где: EZ - потенциал ионизации водородоподобного атома с зарядом ядра Z, а EH - потенциал ионизации атома водорода. Очевидно, что здесь мы имеем тот случай, когда без хорошей математической идеи решить задачу о потенциалах ионизации атомов невозможно. А идея заключается в следующем (кстати, она имеет общий характер и может быть использована для широкого круга аналогичных задач). Введем в формулу (16.1) понятие эффективного заряда:
Zэфф=AZ (16.2),
где А отражает совместное влияние взаимодействия электронов между собой и магнитное взаимодействие. Подставим (16.2) в (16.1) и преобразуем к виду:
![]() (16.3),
(16.3),
где: EMn - n-ый потенциал ионизации М-подобного атома, EM1 - первый потенциал ионизации M-подобного атома, Z - заряд иона, который образуется при удалении данного электрона, A - параметр, зависящий от строения электронных оболочек M-подобного атома.
Формула (16.3) будет справедлива, при A=const, только при Z![]()
![]() , т.к. форма орбит
электронов зависит от Z, особенно при малых Z.
Чаще всего в таблицах приводят экспериментальные значения первых десяти
потенциалов ионизации и даже этого совершенно недостаточно, чтобы вычислить
точное значение параметра A в формуле (16.3). Чтобы решить этот вопрос,
опишем экспериментальные значения потенциалов ионизации М-подобных
атомов любым эмпирическим выражением, но с непременным условием, чтобы оно при Z
, т.к. форма орбит
электронов зависит от Z, особенно при малых Z.
Чаще всего в таблицах приводят экспериментальные значения первых десяти
потенциалов ионизации и даже этого совершенно недостаточно, чтобы вычислить
точное значение параметра A в формуле (16.3). Чтобы решить этот вопрос,
опишем экспериментальные значения потенциалов ионизации М-подобных
атомов любым эмпирическим выражением, но с непременным условием, чтобы оно при Z![]()
![]() давало формулу
(16.3). Тогда не требуется знать большой ряд потенциалов ионизации и параметр А можно вычислить с любой точностью для любого М-подобного
атома.
давало формулу
(16.3). Тогда не требуется знать большой ряд потенциалов ионизации и параметр А можно вычислить с любой точностью для любого М-подобного
атома.
Например, для первых трех периодов таблицы Менделеева предлагаю следующую полуэмпирическую зависимость (вывод ее не приводится, т.к. не представляет интереса, параметр В в этой зависимости также не имеет значения):
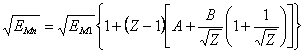 (16.4).
(16.4).
Выражение (16.4) при Z![]()
![]() дает
(16.3), что является необходимым условием.
дает
(16.3), что является необходимым условием.
Для бороподобных атомов (в качестве примера), в (16.4): А=0,63406, В=0,06633. Сравнение экспериментальных значений энергии ионизации с расчетом по (16.4) приведено в таблице 16.1.
Таблица 16.1.
|
Бороподобный атом |
C+1 |
N+2 |
O+3 |
F+4 |
Ne+5
|
|
Z |
2 |
3 |
4 |
5 |
6 |
|
Е эксп. (эв) |
24,376 |
47,426 |
77,39 |
114,21 |
157,9 |
|
Е по (57),эв |
24,376 |
47,350 |
77,25 |
114,06 |
157,8 |
|
Бороподобный атом |
Na+6 |
Mg+7 |
Al+8 |
Si+9
|
|
|
Z |
7 |
8 |
9 |
10 |
|
|
Е эксп. (эв) |
208,44 |
256,84 |
330,1 |
401,3 |
|
|
Е по (57),эв |
208,37 |
256,83 |
330,1 |
401,3 |
|
Поскольку ошибка не превышает 0,2%, будем считать выражение (16.4) удовлетворительным для практического пользования.
Значения параметра А для элементов первых трех периодов приведены в таблице 16.2.
Таблица 16.2.
|
Элемент |
H |
He |
Li |
Be |
B |
|
A |
1,00000 |
0,74271 |
0,78910 |
0,60122 |
0,63406 |
|
Элемент |
C |
N |
O |
F |
Ne |
|
A |
0,54574 |
0,48029 |
0,49382 |
0,43789 |
0,39704 |
|
Элемент |
Na |
Mg |
Al |
Si |
P |
|
A |
0,54411 |
0,45078 |
0,50804 |
0,44081 |
0,39181 |
|
Элемент |
S |
Cl |
Ar |
|
|
|
A |
0,39043 |
0,35119 |
0,31984 |
|
|
Для всех остальных элементов выражение (16.4) уже не позволяет достаточно точно вычислить параметр А из-за совершенно другого строения оболочек (см. табл. 15.1) и требуется другое эмпирическое выражение, которое нас сейчас интересовать не будет, поскольку принцип ясен.
Из-за того, что параметр А освобожден от влияния взаимодействия электрона с ядром и его значение не зависит от строения М-подобного атома (в том числе и от перестройки электронной структуры при удалении данного электрона), очевидно, что электроны, образующие одну и ту же оболочку атома и находящиеся от его ядра на одном и том же расстоянии должны иметь и одинаковую энергию ионизации E0 (опять противоречие с принципом Паули):
![]() (16.5).
(16.5).
Понятно, что в первом коротком периоде E0=13,595 эв, т.е. равна энергии ионизации атома водорода. Действительно, для гелия: E0 = EHe1×A2 = 24,58×0,742712 = 13,559 эв, поэтому величина 24,58 - 13,559 = 11,021 эв обусловлена, в основном, магнитным взаимодействием двух электронов в атоме гелия (если не принимать в расчет гравидинамическое взаимодействие). Для элементов второго периода E0=3,3535 эв, а третьего периода E0=1,5771 эв. Подставляя эти значения в (16.5), найдем первые потенциалы ионизации этих элементов, они представлены в таблице 16.3.
Таблица 16.3.
|
Элемент |
Li |
Be |
B |
C |
N |
|
Е экс. (эв) |
5,39 |
9,32 |
8,296 |
11,264 |
14,54 |
|
Е по (16.5), (эв) |
5,39 |
9,28 |
8,341 |
11,259 |
14,54 |
|
Элемент |
O |
F |
Ne |
Na |
Mg |
|
Е экс. (эв) |
13,614 |
17,418 |
21,559 |
5,138 |
7,644 |
|
Е по (16.5), (эв) |
13,752 |
17,493 |
21,273 |
5,327 |
7,761 |
|
Элемент |
Al |
Si |
P |
S |
Cl |
|
Е экс. (эв) |
5,984 |
8,149 |
10,55 |
10,357 |
13,01 |
|
Е по (16.5), (эв) |
6,110 |
8,116 |
10,27 |
10,346 |
12,79 |
|
Элемент |
Ar |
|
|||
|
Е экс. (эв) |
15,755 |
|
|||
|
Е по (16.5), (эв) |
15,416 |
|
|||
Структурный параметр А полностью коррелирует с тем электронным строением атомов, которое мы установили ранее. Как и следовало ожидать, строение атома полностью определяет энергию связей электронов в его составе. Подтвердилось оболочечное размещение электронов вокруг ядра. Показано существенное влияние магнитного взаимодействия на энергию связи электрона с атомом (в которое включается и гравидинамическое взаимодействие, но оно в данном случае незначительно). Экспериментальные потенциалы ионизации полностью соответствуют строению атомов, изложенному в этой книге.
|
|
|
|
|
|
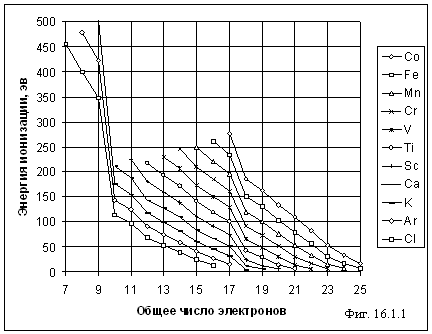
На фигуре 16.1.1 представлена зависимость энергии ионизации ионов различных элементов от общего количества электронов, принадлежащих иону. При 10 электронах электронная конфигурация ионов соответствует неону, а при 18 электронах – аргону. Поэтому при последующей ионизации таких ионов наблюдается резкое увеличение энергии ионизации, т.к. приходится разрушать заполненную электронную оболочку инертных газов. Подобие кривых рис. 16.1.1 доказывает подобие электронной структуры соответствующих ионов. Здесь только надо добавить, что хотя электронные структуры ионов с одним и тем же общим числом электронов подобны, но сами электроны расположены гораздо ближе к ядру для многозарядных ионов, что вполне естественно.
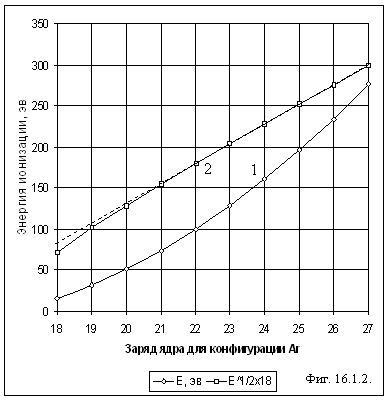
На рис. 16.1.2 для электронной конфигурации ионов,
соответствующей аргону, приведены энергии ионизации E в зависимости от заряда ядра иона
(кривая 1) и эти же значения, подсчитанные по формуле ![]() (кривая 2).
В сравнении с пунктирной прямой видно, что с увеличением заряда ядра при одной
и той же конфигурации электронов энергия ионизации
пропорциональна квадрату заряда ядра. Чем больше заряд иона, тем точнее
выполняется квадратичная зависимость, т.е. взаимодействием электронов между
собой в этом случае можно пренебречь.
(кривая 2).
В сравнении с пунктирной прямой видно, что с увеличением заряда ядра при одной
и той же конфигурации электронов энергия ионизации
пропорциональна квадрату заряда ядра. Чем больше заряд иона, тем точнее
выполняется квадратичная зависимость, т.е. взаимодействием электронов между
собой в этом случае можно пренебречь.
Для того чтобы получить спектральную линию в оптическом диапазоне, нужна потеря избыточной энергии электрона, порядка 5-10 эв. В то же время, энергия связи электрона в ионе Fe+13 излучающего зеленую линию «корония» в спектре Солнца составляет примерно 450 эв. Этот ион имеет 13 электронов и их конфигурация подобна электронной конфигурации алюминия. Эксцентриситет орбиты возбужденного электрона равен отношению избыточной энергии к энергии связи. В рассматриваемом случае этот эксцентриситет приблизительно равен 0,015. Орбиты с таким малым эксцентриситетом находятся вблизи основного состояния (круговая орбита) поэтому метастабильны – электронам необходимо значительно большее время для перехода в основное состояние. В подобных случаях мы можем наблюдать «запрещенные» (в терминах официальной физики) спектральные линии, если ион находится в очень разреженной среде и не может растерять избыточную энергию при столкновениях с другими частицами.
|
|
|
|
|
|
16.2. Расчет потенциалов ионизации
Кто хоть однажды видел спектры сложных атомов, тот сможет
посочувствовать астрономам, которые вынуждены разбираться в тысячах
спектральных линий не только данного элемента, но и в их смеси с другими
элементами, как это реально наблюдается в космических объектах. В результате
перед глазами исследователя появляется такой штрих-код
в котором практически невозможно разобраться. Предположим, что мы имеем набор
спектров всех предполагаемых элементов, существующих на исследуемом объекте.
Тогда современная компьютерная техника сможет разделить спектр
сложной смеси на спектры отдельных элементов. Но здесь есть еще одна
серьезная трудность: мы не знаем спектры многозарядных ионов. Например, в
короне Солнца наблюдается яркая зеленая линия ионов Fe+13 (ее
приписывали новому элементу «коронию»). А какой весь спектр этого иона и подобных ему? Его невозможно воспроизвести в лабораторных
условиях, а чтобы сделать теоретический расчет, надо, по крайней мере, знать
потенциалы ионизации перехода Fe+12![]() Fe+13
Fe+13![]() Fe+14, которые
также невозможно определить экспериментально. Данная глава поможет выйти из
этой безвыходной ситуации и рассчитать потенциалы ионизации любых многозарядных
ионов с высокой точностью.
Fe+14, которые
также невозможно определить экспериментально. Данная глава поможет выйти из
этой безвыходной ситуации и рассчитать потенциалы ионизации любых многозарядных
ионов с высокой точностью.
Новая физика представляет формирование атомных спектров таким образом. Все электроны атома находятся в основном состоянии и ничего не излучают. У каждого электрона это состояние строго индивидуально. Если атом хорошенько встряхнуть, то полученная энергия перераспределяется между всеми электронами и они займут каждый свое индивидуальное возбужденное состояние. При возвращении в основное состояние каждый электрон будет излучать несколько серий спектральных линий, число линий в каждой серии, в принципе, бесконечно. Только предел каждой серии указывает, что электрон снова занял основное состояние. При увеличении заряда ядра плотность энергетических состояний вблизи основного состояния увеличивается, поэтому расстояние между спектральными линиями изменяется. Но как бы велика не была энергия связи электрона с ядром, вблизи основного состояния он будет излучать фотоны оптического и инфракрасного диапазона. На основе изложенного механизма формирования атомных спектров становится понятной появление спектров, содержащих многие тысячи линий.
В главе 16 приведены эмпирические зависимости для расчета потенциалов ионизации, но их нельзя признать удовлетворительными. В главе 16.1 (фигура 16.1.1) показано, что структура ионов с одинаковым числом электронов подобна, а на фигуре 16.1.2 показано, что энергия ионизации в степени ½ начиная с Z+5 и выше практически линейно зависит от заряда ядра (при одном и том же числе электронов). При заряде <Z+5 взаимодействие электронов между собой (магнитное и электростатическое) уменьшает потенциал ионизации, насколько уменьшается потенциал ионизации в каждом конкретном случае невозможно посчитать, как невозможно решить задачу многих тел. При достаточно большом заряде ядра взаимодействие электронов между собой практически не влияет на взаимодействие с ядром, поэтому функция E(ион)^1/2 ~ Z становится линейной.
Автор, пользуясь данными «Справочник химика», т.1, 1963, стр. 325-327 не поленился составить расчетные уравнения для всех элементов, данные по энергии ионизации (эв) которых доступны. Результаты представлены в таблице 16.2.1. В первой колонке – символ элемента, во второй колонке – заряд ядра этого элемента, в третьей колонке – формула для расчета энергии ионизации любых ионов, которые содержат количество электронов, равное номеру формулы (и только это количество!), в последующих колонках приводится сравнение экспериментального значения энергии ионизации ионов с расчетом по указанной формуле. Например, посчитаем энергию ионизации иона Fe+12. Заряд ядра железа 26, в указанном ионе содержится 26-12=14 электронов. Следовательно этот ион относится к Si-подобным атомам (по аналогии с водородоподобными атомами, содержащими один электрон). Поэтому расчетная формула будет №14: E14=(1,302Z-14,783)2. Мы в эту формулу должны подставить Z=26. В результате получим искомый потенциал ионизации 363,63 эв. Для иона Fe+14 аналогичные расчеты по формуле 12 дадут 460,92 эв.
Таблица 16.2.1.
|
Символ элемента
|
Заряд ядра Z
|
Расчетная формула
|
Заряд ядра |
Z+4 |
Z+5 |
Z+6
|
Z+7
|
Z+8
|
Z+9
|
|
|
H |
1 |
E1=(3,688Z)2 |
Е(эксперимент) |
340,03 |
489,65 |
666,47 |
870,49 |
1101,71 |
1360,13 |
|
|
Е(расчет) |
340,03 |
489,65 |
666,47 |
870,49 |
1101,71 |
1360,13 |
||||
|
He |
2 |
E2=(3,701Z-2,441)2
|
Е(эксперимент) |
391,99 |
551,93 |
739,11 |
953,8 |
1195,4 |
1464,7 |
|
|
Е(расчет) |
390,65 |
550,65 |
738,05 |
952,83 |
1195 |
1454,5 |
||||
|
Li |
3 |
E3=(1,852Z-3,062)2
|
Е(эксперимент) |
97,86 |
138,08 |
185,14 |
239,1 |
299,7 |
367,2 |
|
|
Е(расчет) |
98,05 |
138,16 |
185,12 |
238,95 |
299,64 |
367,18 |
||||
|
Be |
4 |
E4=(1,857Z-4,182)2
|
Е(эксперимент) |
113,87 |
157,12 |
207,2 |
264,2 |
328 |
398,6 |
|
|
Е(расчет) |
113,93 |
157.03 |
207.01 |
263,9 |
327,68 |
398,36 |
||||
|
B |
5 |
E5=(1,869Z-6,134)2
|
Е(эксперимент) |
114,21 |
157,9 |
208,44 |
265,84 |
330,1 |
401,3 |
|
|
Е(расчет) |
114,21 |
157,65 |
208,08 |
265,49 |
329,89 |
401,28 |
||||
|
C |
6 |
E6=(1,881Z-7,59)2
|
Е(эксперимент) |
126,4 |
172,4 |
225,3 |
285,13 |
351,8 |
425,4 |
|
|
Е(расчет) |
125,89 |
171,64 |
224,46 |
284,36 |
351,34 |
425,39 |
||||
|
N |
7 |
E7=(1,881Z-8,918)2
|
Е(эксперимент) |
138,6 |
186,8 |
241,8 |
304 |
372,8 |
448,5 |
|
|
Е(расчет) |
138,6 |
186,43 |
241,34 |
303,32 |
372,37 |
448,51 |
||||
|
O |
8 |
E8=(1,891Z-10,806)2
|
Е(эксперимент) |
141,23 |
190,42 |
246,41 |
309,3 |
378,9 |
455,3 |
|
|
Е(расчет) |
141,28 |
189,8 |
245,49 |
308,32 |
378,3 |
455,44 |
||||
|
F |
9 |
E9=(1,905Z-12,404)2
|
Е(эксперимент) |
153,8 |
205,1 |
263,3 |
328,4 |
400,3 |
479 |
|
|
Е(расчет) |
152,79 |
203,52 |
261,5 |
326,74 |
399,24 |
479 |
||||
|
Ne |
10 |
E10=(1,915Z-13,94)2
|
Е(эксперимент) |
166,73 |
220,41 |
280,99 |
348,5 |
422,6 |
503,8 |
|
|
Е(расчет) |
165,64 |
218,6 |
378,89 |
346,52 |
421,48 |
503,78 |
||||
|
Na |
11 |
E11=(1,303Z-11,524)2
|
Е(эксперимент) |
65,01 |
88 |
114,2 |
143,4 |
176 |
211,3 |
|
|
Е(расчет) |
64,34 |
86,94 |
112,93 |
142,32 |
175,11 |
211,29 |
||||
|
Mg |
12 |
E12=(1,296Z-12,227)2
|
Е(эксперимент) |
72,5 |
96,6 |
123,9 |
154,3 |
187,9 |
224,9 |
|
|
Е(расчет) |
72,4 |
96,14 |
123,23 |
153,69 |
187,5 |
224,67 |
||||
|
Al |
13 |
E13=(1,293Z-13,719)2
|
Е(эксперимент) |
67,8 |
91,3 |
117,9 |
143,3 |
180,2 |
216,9 |
|
|
Е(расчет) |
68,26 |
91,3 |
117,68 |
147,4 |
180,47 |
216,88 |
||||
|
Si |
14 |
E14=(1,302Z-14,783)2
|
Е(эксперимент) |
75 |
99,4 |
127,9 |
159,2 |
193,1 |
230,2 |
|
|
Е(расчет) |
74,87 |
99,1 |
126,72 |
157,73 |
192,13 |
229.92 |
||||
|
P |
15 |
E15=(1,319Z-15,977)2
|
Е(эксперимент) |
82,6 |
109 |
139 |
172 |
206 |
246 |
|
|
Е(расчет) |
82,52 |
108,22 |
137,4 |
170,07 |
206,21 |
245,83 |
||||
|
S |
16 |
E16=(1,311Z-16,995)2
|
Е(эксперимент) |
84 |
111 |
141 |
174 |
209 |
249 |
|
|
Е(расчет) |
85,1 |
111 |
140,35 |
173,13 |
209,35 |
249 |
||||
|
Cl |
17 |
E17=(1,321Z-18,16)2
|
Е(эксперимент) |
91,8 |
119 |
151 |
185 |
221 |
262 |
|
|
Е(расчет) |
91,8 |
118,85 |
149,4 |
183,44 |
220,97 |
261,99 |
||||
|
Ar |
18 |
E18=(1,33Z-19,27)2
|
Е(эксперимент) |
99,8 |
128,9 |
161,1 |
196,4 |
234,4 |
276,9 |
|
|
Е(расчет) |
99,8 |
128,14 |
160,02 |
195,44 |
234,4 |
276,89 |
||||
|
K |
19 |
E19=(1,362Z-23,176)2
|
Е(эксперимент) |
65,2 |
90,6 |
120 |
151 |
185,9 |
224 |
|
|
Е(расчет) |
66,42 |
90,48 |
118,24 |
149,72 |
184,91 |
223,8 |
||||
|
Ca |
20 |
E20=(1,381-24,525)2
|
Е(эксперимент) |
73 |
100 |
130 |
163 |
200 |
241 |
|
|
Е(расчет) |
74,29 |
100 |
129,53 |
162,87 |
200,02 |
240,99 |
||||
|
Sc |
21 |
E21=(1,4Z-26,272)2
|
Е(эксперимент) |
76 |
103 |
133 |
168 |
206 |
247 |
|
|
Е(расчет) |
76,18 |
102,58 |
132,89 |
167,13 |
205,29 |
247,37 |
||||
|
Ti |
22 |
E22=(1,515Z-30,497)2
|
Е(эксперимент) |
79 |
109 |
143 |
182 |
224 |
271 |
|
|
Е(расчет) |
79,08 |
108,33 |
142,16 |
180,58 |
223,59 |
271,19 |
||||
|
V |
23 |
E23=(1,542Z-32,601)2
|
Е(эксперимент) |
82 |
113 |
148 |
188 |
231 |
280 |
|
|
Е(расчет) |
81,59 |
111,83 |
146,82 |
186,57 |
231,07 |
280,33 |
||||
|
Cr |
24 |
E24=(1,528Z-33,879)2
|
Е(эксперимент) |
79 |
109 |
144 |
183 |
226 |
274 |
|
|
Е(расчет) |
79,3 |
108,85 |
143,06 |
181,95 |
225,51 |
273,74 |
||||
|
Mn |
25 |
E25=(1,529Z-35,193)2
|
Е(эксперимент) |
83 |
114 |
149 |
189 |
234 |
282 |
|
|
Е(расчет) |
83,69 |
114 |
148,99 |
188,65 |
232,99 |
282 |
||||
|
Fe |
26 |
E26=(1,549Z-37,156)2
|
Е(эксперимент) |
86 |
118 |
155 |
196 |
241 |
291 |
|
|
Е(расчет) |
86,75 |
118 |
154,06 |
194,91 |
240,56 |
291 |
||||
|
Co |
27 |
E27=(1,557Z-38,75)2
|
Е(эксперимент) |
90 |
123 |
160 |
202 |
248 |
300 |
|
|
Е(расчет) |
90,57 |
122,63 |
159,54 |
201,3 |
247,9 |
299,36 |
||||
|
Ni |
28 |
E28=(1,338Z-32,854)2
|
Е(эксперимент) |
93,4 |
127,5 |
155 |
193 |
234 |
277 |
|
|
Е(расчет) |
99,24 |
127,69 |
159,72 |
195,33 |
234,52 |
277,29 |
||||
|
Cu |
29 |
E29=(1,061Z-27)2
|
Е(эксперимент) |
62,9 |
82,1 |
103 |
126 |
150 |
177 |
|
|
Е(расчет) |
64,21 |
82,34 |
102,72 |
125,35 |
150,23 |
177,37 |
||||
|
Zn |
30 |
E30=(1,102Z-29,148)2
|
Е(эксперимент) |
68,3 |
88,6 |
111 |
136 |
162 |
191 |
|
|
Е(расчет) |
69,22 |
88,77 |
110,75 |
135,16 |
162 |
191,27 |
||||
|
Ga |
31 |
E31=(1,073Z-29,767)2
|
Е(эксперимент) |
59,7 |
78,5 |
99,2 |
122,3 |
146,2 |
173 |
|
|
Е(расчет) |
60,65 |
78,52 |
98,68 |
121,15 |
145,93 |
173 |
||||
|
Ge |
32 |
E32=(1,119Z-32,233)2
|
Е(эксперимент) |
64,7 |
84,4 |
106 |
129 |
154 |
186 |
|
|
Е(расчет) |
64,82 |
84,09 |
105,86 |
130,14 |
156,93 |
186,21 |
||||
|
As |
33 |
E33=(1,053Z-30,298)2
|
Е(эксперимент) |
71 |
90,8 |
116 |
139 |
165 |
194 |
|
|
Е(расчет) |
75.05 |
94,4 |
115,97 |
139,76 |
165,77 |
193,99 |
||||
|
Se |
34 |
E34=(1,08Z-32,476)2
|
Е(эксперимент) |
71,6 |
93 |
116 |
141 |
167 |
195 |
|
|
Е(расчет) |
73,34 |
93,01 |
115 |
139,33 |
166 |
195 |
||||
|
Br |
35 |
E35=(1,19Z-37,663)
|
Е(эксперимент) |
77 |
99,4 |
124 |
153 |
183 |
216 |
|
|
Е(расчет) |
76,51 |
98,74 |
123,81 |
151,71 |
182,44 |
216 |
||||
|
Kr |
36 |
E36=(1,123Z-35,535)2
|
Е(эксперимент) |
82,3 |
110,4 |
131 |
161 |
192 |
225 |
|
|
Е(расчет) |
88,08 |
110,42 |
135,28 |
162,66 |
192,57 |
225 |
||||
|
Rb |
37 |
E37=(1,252Z-44,25)2
|
Е(эксперимент) |
50 |
67 |
94 |
119 |
147 |
178 |
|
|
Е(расчет) |
50,15 |
69,45 |
91,89 |
117,46 |
146,17 |
178 |
||||
|
Sr |
38 |
E38=(1,239Z-44,558)2
|
Е(эксперимент) |
61,2 |
76 |
100 |
126 |
155 |
187 |
|
|
Е(расчет) |
55,95 |
76,02 |
99,16 |
125,37 |
154,65 |
187,01 |
||||
|
Y |
39 |
E39=(1,238Z-45,46)2
|
Е(эксперимент) |
59 |
81 |
105 |
132 |
162 |
195 |
|
|
Е(расчет) |
60,43 |
81,22 |
105,06 |
131,97 |
161,95 |
194,99 |
||||
|
Zr |
40 |
E40=(1,263Z-47,604)2
|
Е(эксперимент) |
63 |
85 |
111 |
139 |
170 |
204 |
|
|
Е(расчет) |
63,49 |
85,21 |
110,12 |
138,23 |
169,52 |
204 |
||||
|
Nb |
41 |
E41=(1,277Z-49,256)2
|
Е(эксперимент) |
67 |
90 |
116 |
146 |
178 |
213 |
|
|
Е(расчет) |
67,39 |
89,98 |
115,84 |
144,96 |
177,34 |
212,98 |
||||
|
Mo |
42 |
E42=(1,28Z-50,754)2
|
Е(эксперимент) |
66 |
89 |
115 |
144 |
176 |
211 |
|
|
Е(расчет) |
66,03 |
88,47 |
114,19 |
143,18 |
175,46 |
211 |
||||
|
Tc |
43 |
E43=(1,293Z-52,404)2
|
Е(эксперимент) |
70 |
94 |
121 |
151 |
184 |
220 |
|
|
Е(расчет) |
70 |
93,32 |
119,97 |
149,96 |
183,3 |
219,99 |
||||
|
Ru |
44 |
E44=(1,308Z-54,191)2
|
Е(эксперимент) |
73 |
98 |
126 |
157 |
192 |
229 |
|
|
Е(расчет) |
73,84 |
98,03 |
125,64 |
156,67 |
191,13 |
229,01 |
||||
|
Rh |
45 |
E45=(1,335Z-56,663)2
|
Е(эксперимент) |
77 |
103 |
132 |
164 |
200 |
238 |
|
|
Е(расчет) |
76,6 |
101,75 |
130,46 |
162,74 |
198,58 |
237,99 |
||||
|
Pd |
46 |
E46=(1,273Z-54,015)2
|
Е(эксперимент) |
91 |
119 |
149 |
182 |
218 |
256 |
|
|
Е(расчет) |
92,83 |
116,98 |
148,38 |
181,01 |
216.88 |
256 |
||||
|
Ag |
47 |
E47=(1,065Z-46,328)2
|
Е(эксперимент) |
63,8 |
83 |
104 |
126 |
150 |
158 |
|
|
Е(расчет) |
63,79 |
81,94 |
102,35 |
125,04 |
150 |
177,21 |
||||
|
Cd |
48 |
E48=(0,944Z-40,963)2
|
Е(эксперимент) |
66 |
83 |
102 |
122 |
144 |
165 |
|
|
Е(расчет) |
66,02 |
82,25 |
100,26 |
120,06 |
141,63 |
164,99 |
||||
|
In |
49 |
E49=(0,938Z-41,289)2
|
Е(эксперимент) |
71 |
89 |
108 |
127 |
151 |
172 |
|
|
Е(расчет) |
70,98 |
87,67 |
106,11 |
126,31 |
148,28 |
172 |
||||
|
Sn |
50 |
E50=(1,023Z-47,629)2
|
Е(эксперимент) |
57 |
74 |
93 |
114 |
137 |
162 |
|
|
Е(расчет) |
57,96 |
74,58 |
93,3 |
114,1 |
137,01 |
162 |
||||
|
Sb |
51 |
E51=(1,041Z-49,383)2
|
Е(эксперимент) |
62 |
80 |
100 |
122 |
146 |
171 |
|
|
Е(расчет) |
61,97 |
79,44 |
99,08 |
120,89 |
144,86 |
171,01 |
||||
|
Te |
52 |
E52=(1,056Z-51,263)2
|
Е(эксперимент) |
62 |
80 |
100 |
122 |
147 |
173 |
|
|
Е(расчет) |
61,98 |
79,73 |
99,7 |
121,9 |
146,34 |
173 |
||||
|
J |
53 |
E53=(1,066Z-52,638)2
|
Е(эксперимент) |
66 |
85 |
106 |
129 |
154 |
181 |
|
|
Е(расчет) |
66 |
84,46 |
105,18 |
128,19 |
153,46 |
181,01 |
||||
|
Xe |
54 |
E54=(1,06Z-53,105)2
|
Е(эксперимент) |
70 |
89 |
111 |
135 |
161 |
187 |
|
|
Е(расчет) |
70,14 |
89,02 |
110,14 |
133,52 |
159,14 |
187,01 |
||||
|
НЕТ ДАННЫХ |
Е(эксперимент) |
|
|
|
|
|
|
|||
|
Е(расчет) |
|
|
|
|
|
|
||||
|
Tu |
69 |
E69=(1,075Z-71,767)2
|
Е(эксперимент) |
45 |
61 |
79 |
99 |
121 |
146 |
|
|
Е(расчет) |
45 |
60,57 |
78,46 |
98,66 |
121,18 |
146 |
||||
|
Yb |
70 |
E70=(1,088Z-73,583)2
|
Е(эксперимент) |
48 |
65 |
89 |
104 |
127 |
153 |
|
|
Е(расчет) |
48,01 |
64,27 |
82,9 |
103,9 |
127,26 |
152,99 |
||||
|
Lu |
71 |
E71=(1,091Z-74,671)2
|
Е(эксперимент) |
51 |
68 |
88 |
109 |
133 |
159 |
|
|
Е(расчет) |
51,18 |
67,98 |
87,16 |
108,72 |
132,66 |
158,99 |
||||
|
Hf |
72 |
E72=(1,1Z-76,216)2
|
Е(эксперимент) |
54 |
72 |
92 |
114 |
139 |
166 |
|
|
Е(расчет) |
54,52 |
71,98 |
91,85 |
114,15 |
138,86 |
166 |
||||
|
Ta |
73 |
E73=(1,123Z-78,933)2
|
Е(эксперимент) |
57 |
75 |
96 |
120 |
145 |
173 |
|
|
Е(расчет) |
56,82 |
75,01 |
95,73 |
118,96 |
144,72 |
173 |
||||
|
W |
74 |
E74=(1,126Z-80,458)2
|
Е(эксперимент) |
55 |
73 |
94 |
117 |
142 |
169 |
|
|
Е(расчет) |
54,32 |
72,18 |
92,58 |
115,52 |
140,99 |
169 |
||||
|
Re |
75 |
E75=(1,123Z-81,066)2
|
Е(эксперимент) |
58 |
77 |
98 |
112? |
148 |
176 |
|
|
Е(расчет) |
58,54 |
76,98 |
97,95 |
121,44 |
147,45 |
175,99 |
||||
|
Os |
76 |
E76=(1,144Z-83,712)2
|
Е(эксперимент) |
61 |
81 |
103 |
127 |
154 |
183 |
|
|
Е(расчет) |
60,96 |
80,14 |
101,93 |
126,34 |
153,36 |
183,01 |
||||
|
Ir |
77 |
E77=(1,157Z-85,718)2
|
Е(эксперимент) |
64 |
84 |
107 |
132 |
160 |
190 |
|
|
Е(расчет) |
63,98 |
83,83 |
106.36 |
131,56 |
159,44 |
190 |
||||
|
Pt |
78 |
E78=(1,137Z-84,883)2
|
Е(эксперимент) |
69,7 |
94,4 |
112 |
138 |
166 |
197 |
|
|
Е(расчет) |
69,74 |
90,02 |
112,89 |
138,34 |
166,38 |
197,01 |
||||
|
Au |
79 |
E79=(Z-75,51)2
|
Е(эксперимент) |
56 |
73 |
91 |
111 |
133 |
156 |
|
|
Е(расчет) |
56,1 |
72,08 |
90,06 |
110,04 |
132,02 |
156 |
||||
|
Hg |
80 |
E80=(0,999Z-76,105)2
|
Е(эксперимент) |
61 |
78 |
97 |
117 |
140 |
164 |
|
|
Е(расчет) |
61,01 |
77,62 |
96,22 |
116,81 |
139,4 |
163,99 |
||||
|
Tl |
81 |
E81=(0,98Z-76,158)2
|
Е(эксперимент) |
51 |
67 |
84 |
103 |
123 |
145 |
|
|
Е(расчет) |
51,01 |
65,97 |
82,85 |
101,65 |
122,37 |
145,01 |
||||
|
Pb |
82 |
E82=(0,996Z-78,226)2
|
Е(эксперимент) |
55 |
71 |
89 |
109 |
130 |
154 |
|
|
Е(расчет) |
55,2 |
71 |
88,77 |
108,53 |
130,28 |
154,01 |
||||
|
Bi |
83 |
E83=(1,01Z-80,192)2
|
Е(эксперимент) |
59 |
76 |
95 |
115 |
138 |
162 |
|
|
Е(расчет) |
58,95 |
75,48 |
94,05 |
114,66 |
137,31 |
162 |
||||
|
|
84 |
E84=(1,01Z-81,215)2
|
Е(эксперимент) |
59 |
76 |
94 |
115 |
137 |
? |
|
|
Е(расчет) |
58,75 |
75,26 |
93.8 |
114,38 |
137,01 |
? |
||||
|
|
|
|
|
|
|
|
|
|
|
|
16.3. Значения коэффициентов в формулах энергии ионизации
Значения коэффициентов в формулах энергии ионизации вида EN=(AZ-B)2 из главы 16.2.
Где N численно равно заряду ядра элемента (номеру формулы главы 16.2), а Z – заряду ядра любого иона любого элемента с таким же общим числом электронов, как у элемента N.
Таблица 16.3.1
|
N |
A |
B |
N |
A |
B |
N |
A |
B |
Примечание |
|
1 |
3,688 |
0,000 |
25 |
1,529 |
35,193 |
49 |
0,938 |
41,289 |
В скобках указано число электронов в оболочке или подоболочке таблицы 15.1 |
|
2 |
3,701 (2) |
2,441 |
26 |
1,549 |
37,156 |
50 |
1,023 |
47,629 |
|
|
3 |
1,852 |
3,062 |
27 |
1,557 |
38,750 |
51 |
1,041 |
49,383 |
|
|
4 |
1,857 |
4,182 |
28 |
1,338 (8) |
32,854 |
52 |
1,056 |
51,263 |
|
|
5 |
1,869 |
6,134 |
29 |
1,061 |
27,000 |
53 |
1,066 |
52,638 |
|
|
6 |
1,881 |
7,590 |
30 |
1,102 (2) |
29,148 |
54 |
1,060 (6) |
53,105 |
Для элементов с z=55 до z=68 нет данных |
|
7 |
1,881 |
8,918 |
31 |
1,073 |
29,767 |
69 |
1,070 |
71,767 |
|
|
8 |
1,891 |
10,806 |
32 |
1,119 |
32,233 |
70 |
1,088 |
73,583 |
|
|
9 |
1,905 |
12,404 |
33 |
1,053 |
30,298 |
71 |
1,091 (16) |
74,871 |
|
|
10 |
1,915 (8) |
13,940 |
34 |
1,080 |
32,476 |
72 |
1,100 |
76,216 |
|
|
11 |
1,303 |
11,524 |
35 |
1,190 |
37,663 |
73 |
1,123 |
78,933 |
|
|
12 |
1,296 |
12,227 |
36 |
1,123 (6) |
35,535 |
74 |
1,126 |
80,458 |
|
|
13 |
1,293 |
13,719 |
37 |
1,252 |
44,250 |
75 |
1,123 |
81,066 |
|
|
14 |
1,302 |
14,783 |
38 |
1,239 (2) |
44,558 |
76 |
1,144 |
83,712 |
|
|
15 |
1,319 |
15,977 |
39 |
1,238 |
45,460 |
77 |
1,157 |
85,718 |
|
|
16 |
1,311 |
16,995 |
40 |
1,263 |
47,604 |
78 |
1,137 |
84,883 |
|
|
17 |
1,321 |
18,160 |
41 |
1,277 |
49,256 |
79 |
1,000 (8) |
75,510 |
|
|
18 |
1,330 (8) |
19,270 |
42 |
1,280 |
50,754 |
80 |
0,999 |
76,105 |
|
|
19 |
1,362 |
23,176 |
43 |
1,293 |
52,404 |
81 |
0,980 (2) |
76,158 |
|
|
20 |
1,381 (2) |
24,525 |
44 |
1,308 |
54,191 |
82 |
0,996 |
78,226 |
|
|
21 |
1,400 |
26,272 |
45 |
1,335 |
56,663 |
83 |
1,010 |
80,192 |
|
|
22 |
1,515 |
30,497 |
46 |
1,273 (8) |
54,015 |
84 |
1,010 |
81,215 |
|
|
23 |
1,542 |
32,601 |
47 |
1,065 |
46,328 |
|
|
|
|
|
24 |
1,528 |
33,879 |
48 |
0,944 (2) |
40,963 |
|
|
|
|
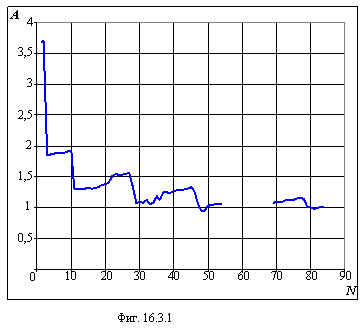
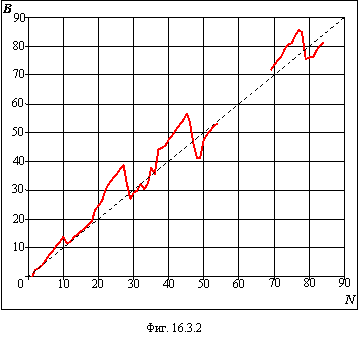
На фигуре 16.3.1 показан ход изменения коэффициента A в зависимости от заряда ядра, а на фигуре 16.3.2 – аналогичный ход
|
|
|
|
|
|
изменения коэффициента B. Поскольку коэффициент B, в среднем,
пропорционален заряду ядра, на фигуре 16.3.2 проведена пунктирная линия прямой
пропорциональности. Из таблицы 16.3.1 и графиков четко видна корреляция
коэффициентов A и B со степенью заполнения электронных оболочек и
подоболочек таблицы 15.1 главы 15 и это подтверждает правильность новой формы
таблицы Менделеева.
|
|
|
|
|
|